El agua, una de las moléculas más abundantes de la Tierra, y de los componentes mayoritarios que forman los seres vivos. Nuestra vida surgió de ella, y sus características la hacen fundamental para poder comprender las reacciones que se originan en el interior de las células, y por tanto en los seres vivos. Su importancia radica por tanto en sus características que son las que siguen:




 Ejercicios 8 y 9 pág. 10; ej. 11 pág. 11
Ejercicios 8 y 9 pág. 10; ej. 11 pág. 11
- Es el disolvente universal por excelencia: puede disolver enlaces iónicos, y debido a su capacidad de formar puentes de hidrógeno puede disociar otro tipo de enlaces dentro de sustancias polares. Capacidad necesaria por tanto para el transporte. Las sustancias que se disuelven en agua se denominan hidrófilas y las que no hidrófobas
- Permanece líquida en un amplio rango de temperatura (0-100 ºC)
- Elevado calor específico: su gran número de puentes de hidrógeno hace que sea necesaria mucha energía para romperlos. Debido a eso, es un gran almacén de energía y así amortigua los cambios de temperatura.
- Su mayor densidad se da en estado líquido a unos 4ºC. De esa manera el hielo puedo flotar sobre el agua.
- Es capaz de formar puentes de hidrógeno consigo misma y con otros compuestos.
Estructura de la molécula de agua.
Entre los tres átomos que forman una molécula de agua encontramos grandes diferencias. El oxígeno presenta alta electronegatividad, por lo que es capar de atraer hacía sí los electrones que comparte con el Hidrógeno. Por su parte, y a la contra, dicho Hidrógeno presenta una muy baja electronegatividad por lo que permite que estos electrones se desplacen hacia el Oxígeno. Es por esto por lo que en una molécula de agua aparecen dos lados opuestos o polos de cargas diferentes, uno más positivo y otro negativo, generando así una molécula polar o con polaridad aunque sea una molécula neutra.
Debido a dicha polaridad, la molécula de agua puede generar atracciones débiles con otras de la misma naturaleza, o que también presenta polaridad, a partir de enlaces que se denominan PUENTES DE HIDRÓGENO.

Las sales minerales
Las sales minerales en el cuerpo las podemos encontrar de dos formas:
- Disueltas en líquidos apareciendo de esta forma disociadas. De esta manera podemos encontrar:
- Cationes: Na, K, Ca...
- Aniones:CO3, SO4, PO4...
- En este estado pueden cumplir diversas funciones reguladoras e incluso antagónicas como el Ca y el Mg en la contracción muscular.
- Pueden aparecer insolubles como algunos fosfatos para funciones esqueléticas y estructurales.
Entre los principales procesos que pueden regular las sales minerales vamos a destacar:
1. El pH. Este es el grado de acidez que presenta una solución dependiendo de la cantidad de protones de H libres que presenta. Cuantos más protones libres presente será más ácido y a la inversa. En el caso de la sangre humana encontramos un pH de 7 que lo consideramos neutro. Si una sustancia como al agua le añadimos otra ácida o básica (contrario a ácida) rápidamente cambiaríamos su naturaleza. En los seres vivos eso no pasa gracias a las sales naturales que neutralizan esta situación amortiguandola, y evitando daños en los procesos celulares.

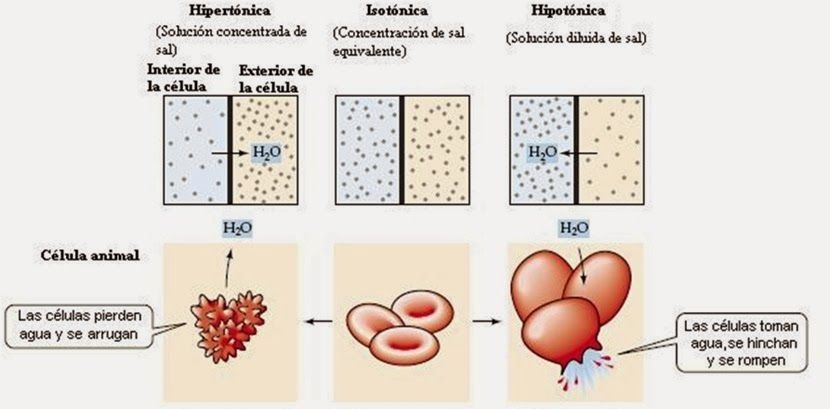
2. Regulación osmótica.
Una ósmosis es el paso de sustancias entre dos disoluciones que la separan una membrana semipermeable; en este paso se permite el paso del disolvente, pero no el del soluto. Este proceso es la base de fenómenos como la formación de la orina. En las células se pueden dar las diferentes situaciones:

 Ejercicios 8 y 9 pág. 10; ej. 11 pág. 11
Ejercicios 8 y 9 pág. 10; ej. 11 pág. 11
Comentarios
Publicar un comentario